วันพุธที่ 21 ตุลาคม พ.ศ. 2563
บทที่ 3 พันธะเคมี
3.1.สัญลักษณ์แบบจุดของลิวอิสและกฎออกเตต
สูตรโครงสร้างแบบจุดสูตรโครงสร้างแบบจุด เป็นการเขียนเฉพาะอิเล็กตรอนในชั้นพลังงานนอกสุดหรือเวเลนซ์อิเล็กตรอนของแต่ละธาตุ โดยใช้จุดแทนอิเล็กตรอน 1 ตัว และใช้จุด 2 จุดแทนอิเล็กตรอนคู่ร่วมพันธะหรือเส้น (-) ก็ได้ เราอาจเรียกโครงสร้างแบบจุดนี้ว่า “โครงสร้างลิวอิส” (Lewis Structure)
หลักการเขียนโครงสร้างแบบจุด
1.ให้เขียนอะตอมทั้งหมด โดยให้อะตอมที่เกิดพันธะอยู่ใกล้กัน2.หาจำนวนเวเลนซ์อิเล็กตรอนทั้งหมด
3.ใส่จุดแทนเวเลนซ์อิเล็กตรอนรอบอะตอมเป็นคู่ๆ โดยจัดให้แต่ละอะตอมมีจำนวนอิเล็กตรอนล้อมรอบครบ 8 ตัว (ยกเว้น He = 2 , Be = 4 , B = 6)
4.ในกรณีที่ใช้เวเลนซ์อิเล็กตรอนจนหมดแล้ว แต่อะตอมมีอิเล็กตรอนไม่ครบ 8 ตัว นั้นหมายถึงว่า อาจมีพันธะคู่หรือพันธะสามเกิดขึ้น
5.กรณีที่มีอะตอม 3 ตัว อะตอมที่อยู่ตรงกลาง คือ อะตอมที่มีค่าอิเล็กโทเนกาติวิตีต่ำ
จากการศึกษาเกี่ยวกับธาตุเฉื่อยเช่น He, Ne, Ar, Kr พบว่าเป็นธาตุที่จัดอยู่ในประเภทโมเลกุลอะตอมเดียวทุกสถานะ คือใน 1 โมเลกุลของธาตุเฉื่อยจะมีเพียง 1 อะตอมทั้งสถานะของแข็ง ของเหลว และก๊าซในธรรมชาติเกือบจะไม่พบสารประกอบของธาตุเฉื่อยเลย
แสดงว่าธาตุเฉื่อยเป็นธาตุที่เสถียรมาก
ดังนั้นธาตุต่างๆ ที่มีเวเลนต์อิเล็กตรอนน้อยกว่า 8 จึงพยายามปรับตัวให้มีโครงสร้างแบบธาตุเฉื่อย เช่น
โดยการรวมตัวกันเป็นโมเลกุลหรือใช้อิเล็กตรอนร่วมกันเพื่อทำให้เวเลนต์อิเล็กตรอนเท่ากับ 8
ส่วนไฮโดรเจนจะพยายามปรับตัวให้มีเวเลนต์อิเล็กตรอนเท่ากับ 2 เหมือนธาตุ He
ข้อยกเว้นสำหรับกฎออกเตต
ดังที่ได้กล่าวมาแล้วว่าอะตอมของธาตุต่าง ๆ มักจะรวมตัวกันเป็นสารประกอบเพื่อให้เป็นไปตามกฎออกเตต ซึ่งจะทำให้สารประกอบนั้นอยู่ในสภาพที่เสถียรเช่น H2O, PCl3, NH3, CO2 แต่อย่างไรก็ตามเมื่อมีการศึกษาให้กว้างขวางออกไป ก็พบว่าสารประกอบบางชนิดมีการจัดเรียงอิเล็กตรอนไม่เป็นไปตามกฎออกเตต บางชนิดมีเวเลนต์อิเล็กตรอนน้อยกว่า 8 และบางชนิดมีเวเลนต์อิเล็กตรอนมากกว่า 8 ซึ่งสารต่างๆ เหล่านี้แม้ว่าจะไม่เป็นไปตามกฎออกเตต แต่ก็อยู่ในภาวะที่ไม่เสถึยร จัดว่าเป็นข้อยกเว้นสำหรับกฎออกเตต ซึ่งสรุปได้ดังนี้
1.พวกที่ไม่ครบออกเตต
ได้แก่สารประกอบของธาตุในคาบที่ 2 ของตารางธาตุ ที่มีเวเลนต์อิเล็กตรอนน้อยกว่า 4 เช่น 4Be และ 5B
4Be = 2 , 2 เวเลนต์อิเล็กตรอนเท่ากับ 2
5B = 2 , 3 เวเลนต์อิเล็กตรอนเท่ากับ 3
ธาตุ Be และ B เมื่อเกิดเป็นสารประกอบโคเวเลนต์ทั่ว ๆ ไปจะไม่ครบออกเตต
2.พวกที่เกินกฎออกเตต
ตามทฤษฎีสารประกอบของธาตุที่อยู่ในคาบที่ 3 ของตารางธาตุเป็นต้นไป สารมารถสร้างพันธะแล้วทำให้อิเล็กตรอนเกิน 8 ได้ (ตามกฎการจัดอิเล็กตรอน 2n2 ในคาบที่ 3 สามารถมีอิเล็กตรอนได้เต็มที่ถึง 18 อิเล็กตรอน) นอกจากสารประกอบที่ไม่เป็นไปตามกฎออกเตตดังที่ได้กล่าวมาแล้ว ยังมีสารประกอบอื่น ๆ อีกบางชนิดซึ่งไม่เป็นไปตามกฎออกเตต เช่น ออกไซด์บางตัวของธาตุไนโตรเจน ( NO และ NO2 )และออกไซด์ของคลอรีน (ClO2) เป็นต้น ธาตุเหล่านี้ (N และ Cl) สามารถมีอิเล็กตรอนที่ไม่ได้จับคู่ หรืออิเล็กตรอนเดี่ยว (Unpaired electron) ซึ่งทำให้แสดงสมบัติเป็น paramagnetic ได้
สารประกอบอื่นๆ สามารถตรวจสอบว่าเป็นไปตามกฎออกเตตหรือไม่ ทำได้โดยนับอิเล็กตรอนจากอะตอมกลางดังนี้
- นับเวเลนซ์อิเล็กตรอนของอะตอมกลางของธาตุนั้นๆ
- นับจำนวนแขนที่เกิดกับอะตอมกลาง
- นับประจุลบของไอออนนั้นๆ
3.3.พันธะโคเวเลนต์
พันธะโคเวเลนต์(Covalent bond) มาจากคำว่า co + valence electron ซึ่งหมายถึง พันธะที่เกิดจากการใช้เวเลนซ์อิเล็กตรอนร่วมกัน ดังเช่น ในกรณีของไฮโดรเจน ดังนั้นลักษณะที่สำคัญของ พันธะโคเวเลนต์ก็คือการที่อะตอมใช้เวเลนต์อิเล็กตรอนร่วมกันเป็นคู่ ๆ
-สารประกอบที่อะตอมแต่ละคู่ยึดเหนี่ยวกันด้วยพันธะโคเวเลนต์ เรียกว่าสารโคเวเลนต์
-โมเลกุลของสารที่อะตอมแต่ละคู่ยึดเหนี่ยวกันด้วยพันธะโคเวเลนต์เรียกว่าโมเลกุลโคเวเลนต์
1. การเกิดพันธะโคเวเลนต์
เนื่องจาก พันธะโคเวเลนต์ เกิดจากการใช้เวเลนต์อิเล็กตรอนร่วมกัน ซึ่งอาจจะใช้ร่วมกันเพียง 1 คู่ หรือมากกว่า 1 คู่ก็ได้
- อิเล็กตรอนคู่ที่อะตอมทั้งสองใช้ร่วมกันเรียกว่า “อิเล็กตรอนคู่ร่วมพันธะ”
- อะตอมที่ใช้อิเล็กตรอนร่วมกันเรียกว่าอะตอมคู่ร่วมพันธะ
* ถ้าอะตอมคู่ร่วมพันธะใช้อิเล็กตรอนร่วมกัน 1 คู่จะเกิดเป็นพันธะโคเวเลนต์ที่เรียกว่า พันธะเดี่ยว เช่น ในโมเลกุลของไฮโดรเจน
* ถ้าอะตอมคู่ร่วมพันธะใช้อิเล็กตรอนร่วมกัน 2 คู่จะเกิดเป็นพันธะโคเวเลนต์ที่เรียกว่า พันธะคู่ เช่น ในโมเลกุลของออกซิเจน
* ถ้าอะตอมคู่ร่วมพันธะใช้อิเล็กตรอนร่วมกัน 3 คู่จะเกิดเป็นพันธะโคเวเลนต์ที่เรียกว่า พันธะสาม เช่น ในโมเลกุลของไฮโดรเจน
จากการศึกษาสารโคเวเลนต์จะพบว่า ธาตุที่จะสร้างพันธะโคเวเลนต์ส่วนมากเป็นธาตุอโลหะกับอโลหะ ทั้งนี้เนื่องจากโลหะมีพลังงานไอออไนเซชันค่อนข้างสูง จึงเสียอิเล็กตรอนได้ยาก เมื่ออโลหะรวมกันเป็นโมเลกุลจึงไม่มีอะตอมใดเสียอิเล็กตรอน มีแต่ใช้อิเล็กตรอนร่วมกันเกิดเป็นพันธะโคเวเลนต์ อย่างไรก็ตามโลหะบางชนิดก็สามารถเกิดพันธะโคเวเลนต์กับอโลหะได้ เช่น Be เกิดเป็นสารโคเวเลนต์คือ BeCl2เป็นต้น
สารประกอบโคเวเลนต์ แบ่งเป็น 2 ประเภท
1. Homonuclear molecule (โมเลกุลของธาตุ) หมายถึงสารประกอบโคเวเลนต์ที่ในหนึ่งโมเลกุลประกอบด้วยอะตอมของธาตุชนิดเดียวกันมายึดกันด้วยพันธะโคเวเลนต์ เช่น H2, O2,Br2 ,N2 ,F2 ,Cl2เป็นต้น
2. Heteronuclear molecule (โมเลกุลของสารประกอบ) หมายถึง สารประกอบโคเวเลนต์ที่ในหนึ่งโมเลกุลประกอบด้วยธาตุตั้งแต่ 2 ชนิดขึ้นไป มายึดกันด้วยพันธะโคเวเลนต์ เช่น HCl , CH4, H2O , H2SO4 ,HClO4เป็นต้น
สมบัติของสารประกอบโคเวเลนต์
สารประกอบโคเวเลนต์ มีสมบัติดังนี้
1. มีสถานะเป็นของแข็ง ของเหลว หรือแก๊ส เช่น
- สถานะของเหลว เช่น น้ำเอทานอลเฮกเซน
- สถานะของแข็ง เช่น น้ำตาลทราย (C12H22O11),แนพทาลีนหรือลูกเหม็น (C10H8)
- สถานะแก๊ส เช่น แก๊สคาร์บอนไดออกไซด์ (CO2),แก๊สมีเทน (CH4),แก๊สโพรเพน (C3H8)
2. มีจุดหลอมเหลวต่ำ หลอมเหลวง่ายเนื่องจากมีแรงยึดเหนี่ยวระหว่างโมเลกุลที่ไม่แข็งแรงสามารถถูกทำลายได้ง่าย
3. มีทั้งละลายน้ำและไม่ละลายน้ำ เช่น เอทานอลละลายน้ำ แต่เฮกเซนไม่ละลายน้ำ
4.สารประกอบโคเวเลนต์ไม่นำไฟฟ้าเนื่องจากมีประจุไฟฟ้าเป็นกลาง และอิเล็กตรอนทั้งหมดถูกใช้เป็นอิเล็กตรอน
การเรียกชื่อสารประกอบโคเวเลนต์
สารประกอบโคเวเลนต์เป็นโมเลกุลของสารที่เกิดจากอะตอมของธาตุตั้งแต่ 2 ชนิดขึ้นไปมาสร้างพันธะโคเวเลนต์ต่อกันด้วยสัดส่วนต่าง ๆ กัน ทำให้เป็นการยากในการเรียกชื่อสาร จึงได้มีการตั้งกฎเกณฑ์ในการเรียกชื่อสารประกอบโคเวเลนต์ขึ้น เพื่อให้สามารถสื่อความเข้าใจถึงลักษณะโครงสร้างของสารประกอบโคเวเลนต์ได้ตรงกัน โดยนักวิทยาศาสตร์ได้กำหนดหลักเกณฑ์ในการเรียกชื่อสารประกอบโคเวเลนต์ไว้ดังนี้
1. ให้เรียกชื่อของธาตุที่อยู่ข้างหน้าก่อนแล้วตามด้วยชื่อของธาตุที่อยู่ด้านหลัง โดยเปลี่ยนเสียงพยางค์ท้ายของธาตุเป็น-ไอด์(-ide) ดังตัวอย่างดังต่อไปนี้
ไฮโดรเจน (H) ออกเสียงเป็น ไฮไดรต์
คาร์บอน (C) ออกเสียงเป็น คาร์ไบด์
ไนโตรเจน (N) ออกเสียงเป็น ไนไตรด์
ฟลูออรีน (F) ออกเสียงเป็น ฟลูออไรด์
คลอรีน (CI) ออกเสียงเป็น คลอไรต์
ออกซิเจน (O) ออกเสียงเป็น ออกไซต์
2. ระบุจำนวนอะตอมของธาตุไว้หน้าชื่อธาตุ โดยวิธีการระบุจำนวนอะตอมของธาตุจะระบุโดยใช้ชื่อตัวเลขในภาษากรีก ดังนี้
1 = มอนอ (mono)
2 = ได (di)
3 = ไตร (tri)
4 = เตตระ (tetra)
5 = เพนตะ (penta)
6 = เฮกซะ (hexa)
7 = เฮปตะ (hepta)
8 = ออกตะ (octa)
9 = โนนะ (nona)
10 = เดคะ (deca)
แต่มีข้อยกเว้น คือ ไม่ต้องมีการระบุจำนวนอะตอมของธาตุที่อยู่ด้านหน้าในกรณีที่ธาตุที่อยู่ด้านหน้ามีอยู่เพียงอะตอมเดียว และไม่จำเป็นต้องมีการระบุจำนวนอะตอมของธาตุในกรณีที่ธาตุที่อยู่ด้านหน้าเป็นธาตุไฮโดรเจน ไม่ว่าจะมีกี่อะตอมก็ตาม
ตัวอย่างการเรียกชื่อสารประกอบโคเวเลนต์
N2O5N เรียกว่า ไดโนโตรเจนเพนตะออกไซด์
N2O เรียกว่า ไดโนโตรเจนมอนอกไซด์
CCI4 เรียกว่า คาร์บอนเตตระคลอไรด์
SO2 เรียกว่า ซัลเฟอร์ไดออกไซด์
CO เรียกว่า คาร์บอนมอนนอกไซด์
CO2 เรียกว่า คาร์บอนไดออกไซด์
H2S เรียกว่า ไฮโดรเจนซัลไฟด์
ความยาวและพลังงานพันธะของสารโคเวเลนต์
รูปร่างโมเลกุลโคเวเลนต์
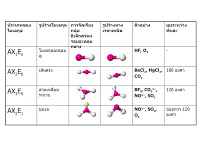

สภาพขั้วของโมเลกุลโคเวเลนต์
พันธะโคเวเลนต์ไม่มีขั้ว
ลักษณะสำคัญของพันธะโคเวเลนต์ไม่มีขั้ว
1. เป็นพันธะโคเวเลนต์ที่เกิดกับคู่อะตอมของธาตุชนิดเดียวกัน
2. เป็นพันธะโคเวเลนต์ที่มีการกระจายอิเล็กตรอนให้แต่ละอะตอมเท่ากัน
3. พันธะโคเวเลนต์ไม่มีขั้วอาจจะเกิดกับพันธะโคเวเลนต์ชนิดพันธะเดี่ยว เช่น Cl - Cl พันธะโคเวเลนต์ชนิดพันธะคู่ เช่น O = O และพันธะโคเวเลนต์ชนิดพันธะสาม เช่น N N
4. พันธะโคเวเลนต์ที่ไม่มีขั้วเกิดในโมเลกุลใดเรียกว่า โมเลกุลไม่มีขั้ว (non- polar molecule)
พันธะโคเวเลนต์มีขั้ว
ลักษณะสำคัญของพันธะโคเวเลนต์มีขั้ว
1. พันธะโคเวเลนต์มีขั้วเกิดกับคู่อะตอมของธาตุต่างชนิดกันที่มีค่าอิเล็กโทรเนกาติวิตีต่างกัน
2. เป็นพันธะโคเวเลนต์ที่มีการกระจายอิเล็กตรอนในแต่ละอะตอมไม่เท่ากัน
3. พันธะโคเวเลนต์มีขั้วเกิดในโมเลกุลใด โมเลกุลนั้นจะมีขั้วหรืออาจจะไม่มีขั้วก็ได้ แต่ถ้าพันธะโคเวเลนต์มีขั้ว เกิดในโมเลกุลที่มีเพียง 2 อะตอม โมเลกุลนั้นต้องเป็นโมเลกุลมีขั้วเสมอ
เขียนสัญลักษณ์แสดงขั้วของพันธะ
ใช้เครื่องหมาย อ่านว่า เดลตา โดยกำหนดให้ว่า พันธะมีขั้วใดที่อะตอมแสดงอำนาจไฟฟ้าลบ (เป็นอะตอมที่มีค่าอิเล็กโทรเนกาติวิตีสูง) ใช้เครื่องหมายแทนด้วย และพันธะโคเวเลนต์มีขั้วใดที่อะตอมแสดงอำนาจไฟฟ้าบวก (เป็นอะตอมที่มีค่าอิเล็กโทรเนกาติวิตีต่ำ ) ใช้เครื่องหมายแทนด้วย เช่น HF และ ClF
แรงยึดเหนี่ยวระหว่างโมเลกุลโคเวเลนต์
เมื่ออะตอมของธาตุต่าง ๆ มีการสร้างพันธะร่วมกันจนกลายเป็นโมเลกุลโคเวเลนต์แล้ว โมเลกุลจะมีแรงยึดเหนี่ยวระหว่างกันทำให้สามารถเข้ามาอยู่ร่วมกันเป็นกลุ่มก้อนของสารต่าง ๆ ได้ โดยแรงยึดเหนี่ยวระหว่างโมเลกุลนี้จะเป็นปัจจัยสำคัญที่มีอิทธิพลต่อสมบัติต่าง ๆ ของสาร เช่น สถานะของสาร จุดเดือดและจุดหลอมเหลว การนำไฟฟ้าของสาร เป็นต้น
ในโมเลกุลโคเวเลนต์ต่าง ๆ ไม่ว่าจะเป็นโมเลกุลที่มีขั้วหรือไม่มีขั้ว ล้วนแต่มีแรงยึดเหนี่ยวระหว่างโมเลกุลด้วยกันทั้งสิ้น ซึ่งแรงยึดเหนี่ยวที่เกิดขึ้นระหว่างโมเลกุลโคเวเลนต์นั้นสามารถแบ่งได้เป็น 2 ประเภท ดังนี้
1. แรงแวนเดอร์วาลส์ (Van der Waals Force) เป็นแรงยึดเหนี่ยวระหว่างโมเลกุลของสาร ซึ่งประกอบด้วยแรง 2 ชนิด คือ
แรงลอนดอน (London force หรือ Disperion force) เป็นแรงยึดเหนี่ยวที่เกิดขึ้นระหว่างโมเลกุลโคเวเลนต์ที่ไม่มีขั้ว มีแรงยึดเหนี่ยวต่ำเกิดจากอิเล็กตรอนคู่ร่วมพันธะที่อยู่ระหว่างอะตอมมีการเคลื่อนที่ไปรอบ ๆ อะตอมทำให้เกิดสภาพขั้วไฟฟ้าอ่อน ๆ ขึ้นชั่วขณะ จึงทำให้โมเลกุลของสารดึงดูดเข้าหากันได้ สารที่มีแรงยึดเหนี่ยวประเภทนี้จึงเป็นสารที่มีจุดเดือดและจุดหลอมเหลวต่ำ
แรงดึงดูดระหว่างขั้ว (Dipole-dipole force) เป็นแรงยึดเหนี่ยวที่เกิดระหว่างโมเลกุลโคเวเลนต์ที่มีขั้วเกิดจากขั้วบวกของโมเลกุลหนึ่งดึงดูดระหว่างขั้วนี้จะมีความแข็งแรงมากกว่าแรงลอนดอน ดังนั้นสารที่มีแรงยึดเหนี่ยวชนิดนี้จะมีจุดเดือดและจุดหลอมเหลวสูงกว่าสารที่ยึดเหนี่ยวกันด้วยแรงลอนดอน
2. พันธะไฮโดรเจน (Hydrogen bond) เป็นแรงยึดเหนี่ยวระหว่างโมเลกุลที่มีลักษณะคล้ายกับแรงดึงดูดระหว่างขั้ว แต่จะเกิดขึ้นในโมเลกุลของสารประกอบที่เกิดจากอะตอมของธาตุไฮโดรเจน (H) ซึ่งสร้างพันธะกับอะตอมของธาตุฟลูออรีน (F) หรือออกซิเจน (O) หรือ ไนโตรเจน (N) เนื่องจากอะตอมของธาตุเหล่านี้มีความสามารถในการดึงดูดอิเล็กตรอนที่สูงกว่าอะตอมของไฮโดรเจนมาก ทำให้สามารถดึงดูดอิเล็กตรอนคู่ร่วมพันธะให้เบี่ยงเบนไปจากแนวกึ่งกลางได้มาก จึงเกิดสภาพขั้วที่รุนแรงกว่ามาก ทำให้พันธะไฮโดรเจนมีความแข็งแรงยากต่อการสลายพันธะ ตัวอย่างของสารประกอบที่มีแรงดึงดูดระหว่างโมเลกุลแบบพันธะไฮโดรเจน ได้แก่ น้ำ (H2O), แอมโมเนีย (NH3) เป็นต้น
3.4.พันธะโลหะ
พันธะโลหะ (Metallic bonding) เป็นพันธะภายในโลหะซึ่งเกี่ยวข้องกับ การเคลื่อนย้าย อิเล็กตรอน อิสระระหว่างแลตทิซของอะตอมโลหะดังนั้นพันธะโลหะจึงอาจเปรียบได้กับเกลือที่หลอมเหลวอะตอมของโลหะมีอิเล็กตรอนพิเศษเฉพาะในวงโคจรชั้นนอกของมันเทียบกับคาบ(period)หรือระดับพลังงานของพวกมัน อิเล็กตรอนที่เคลื่อนย้ายเหล่านี้ เปรียบได้กับทะเลอิเล็กตรอน(Sea of Electrons) ล้อมรอบแลตทิชขนาดใหญ่ของไอออนบวกพันธะโลหะเทียบได้กับพันธะโควาเลนต์ที่เป็น นอน-โพลาร์ ที่จะไม่มีในธาตุโลหะบริสุทธ์ หรือมีน้อยมากในโลหะผสม ความแตกต่าง อิเล็กโตรเนกาทิวิตีระหว่างอะตอม ซึ่งมีส่วนในปฏิกิริยาพันธะ และอิเล็กตรอนที่เกี่ยวข้องในปฏิกิริยาจะเคลื่อนย้ายข้ามระหว่างโครงสร้างผลึกของโลหะ พันธะโลหะเขียนสูตรทางเคมีไม่ได้ เพราะไม่ทราบจำนวนอะตอมที่แท้จริง อาจจะมีเป็นล้านๆ อะตอมก็ได้
แบบจำลองทะเลอิเล็กตรอน (Sea of electrons)
การเกิดพันธะในโลหะนี้ ทำให้โลหะมีสมบัติต่างๆ ดังนี้
- นำไฟฟ้าและความร้อนได้ดี
- มีจุดเดือดและจุดหลอมเหลวสูง
- มีลักษณะเป็นเงาและมีความวาวเมื่อถูกแสง
- สามารถดึงเป็นเส้น ตีเป็นแผ่น หรือบิดงอได้
3.5.การใช้ประโชน์ของสารประกอบไอออนิก สารโคเวเลนต์ และโลหะ
สมบัติบางประการของสารประกอบไอออนิก สารโคเวเลนต์ และโลหะ
จากการที่สารประกอบไอออนิกสารโคเวเลนต์และโลหะมีสมบัติเฉพาะตัวมาว่าการที่ต่างกันจึงสามารถนำมาใช้ประโยชน์ในด้านต่างๆได้ตามความเหมาะสม เช่น
- แอมโมเนียมคลอไรด์และซิงค์คลอไรด์ เป็นสารประกอบไอออนิกที่สามารถนำไฟฟ้าได้จากการแตกตัวเป็นไอออนเมื่อละลายน้ำจึงนำไปใช้เป็นสารอิเล็กโทรไลต์ในถ่านไฟฉาย
- พอลิไวนิลคลอไรด์หรือ PVC เป็นสารโคเวเลนต์ที่ไม่สามารถนำไฟฟ้าได้จึงเป็นฉนวนไฟฟ้าที่หุ้มสายไฟฟ้า
- ซิลิกอนคาร์ไบด์ เป็นสารโคเวเลนต์โครงร่างตาข่ายที่มีจุดหลอมเหลวสูงและมีความแข็งแรงมากจึงนำไปใช้ทำเครื่องบด
- ทองแดงและอะลูมิเนียม เป็นโลหะที่นําไฟฟ้าได้ดีจึงนำไปใช้เป็นตัวนำไฟฟ้าอลูมิเนียมและเหล็กเป็นโลหะที่นําความร้อนได้ดีจึงนำไปทำภาชนะสำหรับประกอบอาหาร เช่น หม้อ กะทะ
บทที่ 2 อะตอมและตารางธาตุ
2.1 แบบจำลองอะตอม
2.1.1 แบบจำลองอะตอมของดอลตัน
ในปีพ.ศ 2346 จอห์นดอลตัน นักวิทยาศาสตร์ชาวอังกฤษได้เสนอทฤษฎีอะตอมเพื่อใช้อธิบายเกี่ยวกับการเปลี่ยนแปลงของมวลของสารก่อนและหลังทำปฏิกิริยาเคมีรวมทั้งอัตราส่วนโดยมวลของธาตุที่รวมกันเป็นสารประกอบหนึ่งหนึ่งซึ่งมีสาระสำคัญดังนี้
1.ประกอบด้วยอนุภาคขนาดเล็กๆเหล่านี้เรียกว่าอะตอมซึ่งแบ่งแยกและทำให้สูญหายไม่ ได้
3.สารประกอบเกิดจากอะตอมของธาตุมากกว่าหนึ่งชนิดทำปฏิกิริยาเคมีกันในอัตราส่วนที่เป็นเลขลงตัวน้อยๆ
ทฤษฎีอะตอมของดอลตันช่วยให้นักวิทยาศาสตร์ในสมัยนั้นสามารถอธิบายลักษณะและสมบัติของอะตอมได้เพียงระดับหนึ่งต่อมาได้มีการศึกษาเกี่ยวกับอะตอมเพิ่มขึ้นและค้นพบว่ามีข้อมูลแบบประกันไม่สอดคล้องกับแนวคิดของดอลตัน เช่นคำว่าต่อมของธาตุชนิดเดียวกันมีมวลแตกต่างกันได้อะตอมสามารถแบ่งแยกได้อีกแนวคิดเกี่ยวกับทฤษฎีอะตอมของดอลตันจึงไม่ถูกต้อง
2.1.2 แบบจําลองอะตอมของทอมสัน
นักวิทยาศาสตร์หลายคนได้ศึกษาการนำไฟฟ้าของแก๊สโดยทดลองเกี่ยวกับผลของการใช้ความต่างศักย์ไฟฟ้าสูงต่อกับการเคลื่อนที่ของประจุไฟฟ้าของอะตอมแก๊สเพื่อให้ได้ข้อมูลที่ให้รายละเอียดเกี่ยวกับโครงสร้างภายในอะตอมโดยผ่านกระแสไฟฟ้าตรงเข้าไปในหลอดแก้วบรรจุแก๊สความดันต่ำซึ่งที่ภาวะนี้มีจำนวนอะตอมของแก๊สไม่หนาแน่นประจุไฟฟ้าสามารถเดินทางผ่านได้ไกลและพบว่าเมื่อเพิ่มความต่างศักย์ระหว่างขั้วไฟฟ้าให้สูงขึ้นจะมีกระแสไฟฟ้าไหลผ่านตลอด ขณะเดียวกันจะมีรังสีออกจากแคโทดไปยังแอโนดรังสีนี้เรียกว่ารังสีแคโทดเรียกหลอดแก้วชนิดนี้ว่าหลอดรังสีแคโทด นักวิทยาศาสตร์ได้ทำการทดลอง เพื่อศึกษาการเคลื่อนที่ของรังสีแคโทดโดยให้เคลื่อนที่ผ่านสนามไฟฟ้าดังรูป
พบว่าแนวการเคลื่อนที่เบนไปจากเดิมโดยเบนเข้าหาขั้วบวกของสนามไฟฟ้าเนื่องจากรังสีแคโทดเบนเข้าหาขั้วบวกของสนามไฟฟ้าจึงสรุปได้ว่า รังสีแคโทดประกอบด้วยอนุภาค ที่มีประจุไฟฟ้าลบ จากข้อมูลการทดลองร่วมกับทฤษฎีทางแม่เหล็กไฟฟ้าทำให้ทอมสันนำมาใช้คำนวณอัตราส่วนของประจุต่อมวลของรังสีแคโทดได้ทอมสันได้ทดลองเพื่อศึกษาอัตราส่วนของประจุต่อมวลของรังสีแคโทดซ้ำหลายครั้งโดยเปลี่ยนชนิดของแก๊สและชนิดของโลหะที่ใช้ทำเป็นขั้วแคโทดปรากฏว่าอัตราส่วนของประจุต่อมวลของรังสีแคโทดมีค่าโดยประมาณเท่ากันคือ 1.76 × 10^8 คูลอมบ์/กรัมจึงสรุปได้ว่าอนุภาครังสีแคโทดที่ออกมาจากโลหะต่างชนิดกันเป็นอนุภาคเดียวกันซึ่งต่อมาได้ด้วยอนุภาคนี้ว่า อิเล็กตรอน
รู้หรือไม่? ในปีพ.ศ 2429 ออยเกนโกลด์ชไตน์ ได้ศึกษาหลอดรังสีแคโทดและได้ค้นพบรังสีแอโนดหรือรังสีแคแนล ซึ่งมีประจุบวกแต่ยัง ลงรายละเอียดไม่ได้ในยุคนั้น จากการค้นพบของโกลด์สไตน์ และการศึกษาเพิ่มเติมของนักวิทยาศาสตร์อีกหลายคนในยุคต่อมาทำให้ได้ข้อสรุปว่าในอะตอมนอกจากจะมีอิเล็กตรอนแล้วยังมีอนุภาคที่เป็นประจุบวกอีกด้วยทำให้อะตอมเป็นกลางทางไฟฟ้า
การค้นพบอิเล็กตรอนของทอมสันทำให้สรุปได้ว่าอะตอมทุกชนิดมีอิเล็กตรอนเป็นองค์ประกอบซึ่งลบล้างแนวคิดที่ว่าอะตอมแบ่งแยกไม่ได้และเนื่องจากสารต่างๆที่อยู่ในสภาวะปกติจะเป็นกลางทางไฟฟ้านักวิทยาศาสตร์จึงสรุปว่าอะตอมเป็นกลางทางไฟฟ้าซึ่งจากข้อมูลดังกล่าวทำให้ทอมสันเสนอแบบจำลองของอะตอมว่า อะตอมเป็นรูปทรงกลมประกอบด้วยเนื้ออะตอมซึ่งมีประจุบวกและอิเล็กตรอนซึ่งมีประจุลบกระจายอยู่ทั่ว ดังรูป
2.1.3 แบบจำลองของรัทเทอร์ฟอร์ด
เมื่อปีพ.ศ 2454 รัทเทอร์ฟอร์ดนักวิทยาศาสตร์ชาวอังกฤษ และ ฮันส์ ไกเกอร์ นักวิทยาศาสตร์ ชาวเยอรมัน ได้ที่สุดแบบจำลองของอะตอมของทอมสันโดยการยิงอนุภาคแอลฟาไปยังแผ่นทองคำบางๆ
ผลการทดลองของรัทเทอร์ฟอร์ด ไม่สามารถอธิบายได้ด้วยแบบจำลองอะตอมของทอมสันรัทเทอร์ฟอร์ดอธิบายลักษณะภายในอะตอมว่าการที่รังสีแอลฟาส่วนใหญ่ผ่านแผ่นทองคำไปได้แสดงว่าภายในแผ่นทองคำต้องมีที่ว่างอยู่เป็นบริเวณกว้างการที่รังสีแอลฟาบางอนุภาคเบี่ยงเบนหรือสะท้อนกลับมาบริเวณด้านในของฉากเรืองแสงแสดงว่าภายในอะตอมน่าจะมีกลุ่มอนุภาคที่มีขนาดเล็กมากมีมวลสูงมากกว่ารังสีแอลฟาและมีประจุบวกและทดสอบจึงได้เสนอแบบจำลองใหม่ว่าอะตอมประกอบด้วยนิวเคลียสที่มีขนาดเล็กอยู่ภายในและมีประจุไฟฟ้าโดยมีอิเล็กตรอนเคลื่อนที่อยู่รอบรอบ ดังรูป
2.1.4 แบบจำลองอะตอมของโบร์
สเปกตรัมแม่เหล็กไฟฟ้าประกอบด้วยคลื่นแม่เหล็กไฟฟ้าที่มีความยาวคลื่นต่างกันและมีความถี่ต่อเนื่องกันเป็นช่วงกว้างมีทั้งที่มองเห็นได้และมองเห็นไม่ได้มีชื่อเรียกต่างกันแสงที่ประสาทตาของมนุษย์สามารถรับรู้ได้เรียกว่าแสงที่ตามองเห็นมีความยาวคลื่นอยู่ในช่วง 400 ถึง 700 นาโนเมตร ซึ่งประกอบด้วยแสงสีต่างๆแต่ประสาทตาของมนุษย์ไม่สามารถแยกแสงที่มองเห็นเป็นสีต่างๆได้เองทำให้มองเห็นสีรวมกันซึ่งเรียกว่าแสงขาวและเมื่อแสงขาว ส่องผ่านปริซึม แสงขาวจะแยกออกเป็นแสงสีรุ้งต่อเนื่องกันเรียกว่าแถบสเปกตรัมของแสงขาว
มักซ์ พลังค์ นักวิทยาศาสตร์ ชาวเยอรมันได้ศึกษาพลังงานของคลื่นแม่เหล็กไฟฟ้าและได้ข้อสรุปเกี่ยวกับความสำคัญระหว่างพลังงานของคลื่นแม่เหล็กไฟฟ้ากับความถี่ของคลื่นนั้นว่าพลังงานของคลื่นแม่เหล็กไฟฟ้าจะแปรผันตามความถี่ของคลื่นและแปรผกผันกับความยาวของคลื่นดังความสัมพันธ์ต่อไปนี้
h คือค่าคงตัวของพลังค์ มีค่า 6.626 × 10^-34 จูลต่อวินาที
v คือความถี่ของคลื่นแม่เหล็กไฟฟ้า มีหน่วยเป็นเฮิรตซ์
c คือความเร็วของคลื่นแม่เหล็กไฟฟ้า เท่ากับ 3 × 10^8 เมตรต่อวินาที
และ แลมดาร์ คือ ความยาวคลื่นมีหน่วยเป็นเมตร ความสัมพันธ์ดังกล่าว เมื่อนำมาคำนวณพลังงานของแถบสีต่างๆในสเปกตรัมของแสงขาวซึ่งมีความยาวคลื่นต่างๆจะได้ ดังนี้
สเปกตรัมแม่เหล็กไฟฟ้าประกอบด้วยคลื่นแม่เหล็กไฟฟ้าที่มีความยาวคลื่นต่างกันและมีความถี่ต่อเนื่องกันเป็นช่วงกว้างมีทั้งที่มองเห็นได้และมองเห็นไม่ได้มีชื่อเรียกต่างกันแสงที่ประสาทตาของมนุษย์สามารถรับรู้ได้เรียกว่าแสงที่ตามองเห็นมีความยาวคลื่นอยู่ในช่วง 400 ถึง 700 นาโนเมตร ซึ่งประกอบด้วยแสงสีต่างๆแต่ประสาทตาของมนุษย์ไม่สามารถแยกแสงที่มองเห็นเป็นสีต่างๆได้เองทำให้มองเห็นสีรวมกันซึ่งเรียกว่าแสงขาวและเมื่อแสงขาว ส่องผ่านปริซึม แสงขาวจะแยกออกเป็นแสงสีรุ้งต่อเนื่องกันเรียกว่าแถบสเปกตรัมของแสงขาว
มักซ์ พลังค์ นักวิทยาศาสตร์ ชาวเยอรมันได้ศึกษาพลังงานของคลื่นแม่เหล็กไฟฟ้าและได้ข้อสรุปเกี่ยวกับความสำคัญระหว่างพลังงานของคลื่นแม่เหล็กไฟฟ้ากับความถี่ของคลื่นนั้นว่าพลังงานของคลื่นแม่เหล็กไฟฟ้าจะแปรผันตามความถี่ของคลื่นและแปรผกผันกับความยาวของคลื่นดังความสัมพันธ์ต่อไปนี้
E แปรผันตรงกับ v
หรือ E = hv
เนื่องจาก E = c/แลมดาร์
ดังนั้น E = hc/แลมดาร์ช
เมื่อ E คือพลังงานของคลื่นแม่เหล็กไฟฟ้า มีหน่วยเป็นจูล
h คือค่าคงตัวของพลังค์ มีค่า 6.626 × 10^-34 จูลต่อวินาที
v คือความถี่ของคลื่นแม่เหล็กไฟฟ้า มีหน่วยเป็นเฮิรตซ์
c คือความเร็วของคลื่นแม่เหล็กไฟฟ้า เท่ากับ 3 × 10^8 เมตรต่อวินาที
และ แลมดาร์ คือ ความยาวคลื่นมีหน่วยเป็นเมตร ความสัมพันธ์ดังกล่าว เมื่อนำมาคำนวณพลังงานของแถบสีต่างๆในสเปกตรัมของแสงขาวซึ่งมีความยาวคลื่นต่างๆจะได้ ดังนี้
จากการทดลองการใช้เกรตติงส่องดูแสงอาทิตย์และแสงจากหลอดฟลูออเรสเซนต์ สังเกตสิ่งที่ปรากฏแล้ว พบว่าสเปกตรัมจากแสงอาทิตย์มีสีต่อเนื่องกันเป็น แถบสเปกตรัม เส้นสเปกตรัมที่มองเห็นจากหลอดฟลูออเรสเซนต์ นอกจากจะมองเห็นเป็นแถบสเปกตรัมของสีชนิดต่างๆแล้วพื้นยังมีเส้นสีต่างๆปรากฏในแถบสเปกตรัมอีกด้วยและจากการสังเกตสเปกตรัมของไฮโดรเจนฮีเลียม นีออน และปรอท เพราะว่าถ้าแต่ละชนิดให้สเปกตรัมที่มีแสงสีต่างกันและมีจำนวน เส้นสีเฉพาะตัวเส้นสีนี้เรียกว่า เส้นสเปกตรัม
ธาตุต่างๆ เมื่อได้รับพลังงานจะเปล่งแสงเป็นสีต่างๆหลายสีเมื่อสีเหล่านั้นรวมกันแล้วจะสังเกตเห็นเป็นสีเดียวกันซึ่งทางเราไม่สามารถบอกความแตกต่างได้แต่เมื่อใช้แผ่นเกรตติงส่องดูจะเห็นเส้นสเปกตรัมของแต่ละธาตุที่มีลักษณะเฉพาะเช่นจำนวนสี จำนวนเส้น หรือตำแหน่งที่เกิดต่างกันไปการเกิดเส้นสเปกตรัมของธาตุอธิบายได้ว่าอิเล็กตรอนซึ่งเคลื่อนที่อยู่รอบบริเวณนิวเคลียสมีพลังงานเฉพาะตัวที่ต่ำหรือกล่าวได้ว่าอะตอมอยู่ใน สถานะพื้น เมื่ออะตอมได้รับ พลังงานเพิ่มขึ้นทำให้อิเล็กตรอนถูกกระตุ้นให้มีพลังงานสูงขึ้นหรือ อะตอมอยู่ใน สถานะกระตุ้น ที่สถานะอะตอมจะไม่เสถียรเนื่องจากมีพลังงานสูงอิเล็กตรอนจึงคายพลังงานออกมาส่วนหนึ่งทำให้อะตอมมีพลังงานลดลงและกลับเข้าสู่สภาพที่มีพลังงานต่ำลงเพื่อให้อะตอมมีความเสถียรมากขึ้นพลังงานส่วนใหญ่ที่ขายออกมาจะปรากฏในรูปพลังงานแสงและสามารถคำนวณได้โดยใช้ความสัมพันธ์ตามสมการของพลังค์ ซึ่งได้กล่าวไว้แล้วในข้างต้นถ้าแสงสีเหล่านี้แยกออกจากกันอย่างชัดเจนจะปรากฏเป็นเส้นสเปกตรัมแต่ถ้าแสงสีที่ปรากฏออกมามีลักษณะต่อเนื่องกันเป็นเส้นเดียวอย่างกับรุ้งหรือจากไส้หลอดไฟฟ้า ซึ่งเป็นโลหะร้อนและมีอะตอมอยู่กันอย่างหนาแน่นจะให้สเปกตรัมเป็นแถบสเปกตรัมซึ่งยากแก่การวิเคราะห์และแปลผลต่อภาวะอิเล็กตรอนที่มีพลังงานต่างๆเรียกว่า ระดับพลังงานของอิเล็กตรอน การเปลี่ยนแปลงพลังงาน ของอิเล็กตรอนระหว่างสถานะการ์ตูนและสถานะพื้นสามารถ อุปมานได้กับการกลิ้งลงบันไดของลูกบอลจากรูปจะเห็นว่าพลังงานศักย์หน้าบันไดแต่ละท่านมีค่าไม่เท่ากันโดยลูกบอลที่อยู่บันไดขั้นต่ำจะมีพลังงานศักย์ต่ำกว่าบันไดขั้นสูงและผลต่างของพลังงานระหว่างบันได 2 ขั้นมีค่าเฉพาะตัวที่แน่นอนโดยบันไดที่อยู่ห่างกันมากๆจะมีผลต่างของพลังงานมากกว่าบันไดที่อยู่ติดกัน
จากการศึกษาเส้นสเปกตรัมของอะตอมไฮโดรเจนทำให้สรุปได้ว่า
2.การเปลี่ยนแปลงระดับพลังงานของอิเล็กตรอนไม่จำเป็นต้องเปลี่ยนไประดับพลังงานที่อยู่ติดกันอาจมีการเปลี่ยนข้ามระดับพลังงานได้และจะอยู่ระหว่างระดับพลังงานไม่ได้
3.ผลต่างระหว่างพลังงานของระดับพลังงานต่ำจะมีค่ามากกว่าผลต่างของระดับพลังงานที่สูงขึ้นไป สร้างความรู้เรื่องการเปลี่ยนแปลงระดับพลังงานของอิเล็กตรอนและการเกิดสเปกตรัมช่วยให้โบร์นักวิทยาศาสตร์ชาวเดนมาร์ก สร้างแบบจำลองอะตอมเพื่อใช้อธิบายพฤติกรรมของอิเล็กตรอนในอะตอมดังกล่าวโดยกล่าวว่าอิเล็กตรอนจะเคลื่อนที่รอบนิวเคลียสเป็นวงกลมคล้ายกับวงโคจรของดาวเคราะห์รอบดวงอาทิตย์แต่ละวงจะมีระดับพลังงานเฉพาะตัวระดับพลังงานของอิเล็กตรอนที่อยู่ใกล้นิวเคลียสที่สุดมีระดับพลังงานต่ำที่สุดเรียกว่าระดับเขตและระดับพลังงานที่อยู่ถัดออกมาเรียกเป็น L M N ... ตามลำดับ
ต่อมาได้มีการใช้ตัวเลขแสดงถึงระดับพลังงานของอิเล็กตรอนคือ n = 1 หมายถึงระดับพลังงานที่ 1 ซึ่งอยู่ใกล้กับบริเวณนิวเคลียสและฉันผ่านมา n = 2 หมายถึงระดับพลังงานที่ 2 ต่อจากนั้น N = 3 4 ... หมายถึงระดับพลังงานที่ 3 4 และสูงขึ้นไปตามลำดับ
2.1.5 แบบจำลองอะตอมแบบกลุ่มหมอก
แบบจำลองอะตอมของโบร์มีข้อจำกัดคือไม่สามารถใช้อธิบายสเปกตรัมของอะตอมที่มีลายเล็กตรอนได้นักวิทยาศาสตร์จึงได้ศึกษาเพิ่มเติมจนได้รับข้อมูลเพียงพอที่เชื่อถือว่าอิเล็กตรอนมีสมบัติเป็นทางอนุภาพและคลื่นโดยเคลื่อนที่รอบนิวเคลียสบริเวณที่พบอิเล็กตรอนมีหลายลักษณะเป็นรูปทรงต่างๆกันตามระดับพลังงานของอิเล็กตรอนจากการประยุกต์ใช้สมการทางคณิตศาสตร์และใช้คอมพิวเตอร์ช่วยในการคำนวณเพื่อหาโอกาสที่จะพบอิเล็กตรอนในระดับพลังงานต่างๆพบว่าสามารถอธิบายเส้นสเปกตรัมของธาตุได้ถูกต้องกว่าแบบจำลองของโบร์ และสามารถอธิบายได้ว่าอิเล็กตรอนมีขนาดเล็กมาก และเคลื่อนที่อย่างรวดเร็วตลอดเวลาไปทั่วทั้งอะตอมจึงไม่สามารถบอกตำแหน่งที่แน่นอนของอิเล็กตรอนได้อย่างไรก็ตามนักวิทยาศาสตร์พบว่ามีโอกาสที่จะพบอิเล็กตรอนรอบนิวเคลียสบางบริเวณเท่านั้นทำให้สามารถมโนภาพได้ว่าอะตอมประกอบด้วยกลุ่มหมอกอิเล็กตรอนรอบนิวเคลียสบริเวณที่กลุ่มออกหรือแสดงว่ามีโอกาสที่จะพบอิเล็กตรอนได้มากกว่าบริเวณที่มีกลุ่มออกจากเรื่องแบบจำลองนี้ว่าแบบจำลองอะตอมแบบกลุ่มหมอก ดังรูป2.2 อนุภาคในอะตอมและไอโซโทป
ในหัวข้อที่ผ่านมานักเรียนได้ทราบแล้วว่าทอมสันค้นพบอิเล็กตรอนและค่าประจุต่อมวลในหัวข้อนี้นักเรียนจะได้รู้ เกี่ยวกับอนุภาคชนิดอื่นที่เป็นองค์ประกอบของอะตอม
ในหัวข้อที่ผ่านมานักเรียนได้ทราบแล้วว่าทอมสันค้นพบอิเล็กตรอนและค่าประจุต่อมวลในหัวข้อนี้นักเรียนจะได้รู้ เกี่ยวกับอนุภาคชนิดอื่นที่เป็นองค์ประกอบของอะตอม
2.2.1 อนุภาคในอะตอม
ในปีพ.ศ 2451 โรเบิร์ตแอนดรูส์มิลลิแกน นักวิทยาศาสตร์ชาวอเมริกันได้ทำการหาค่าประจุของอิเล็กตรอนโดยการอาศัยสังเกตหยดน้ำมันในสนามไฟฟ้า ดังรูป
เมื่อไรน้ำมันที่ร่วงผ่านรูบนขั้วไฟฟ้าบวกกระทบรังสีจะมีประจุไฟฟ้าเกิดขึ้นทำให้ละอองน้ำมันบังหมดเคลื่อนที่เข้าหาขั้วไฟฟ้าบวกบางหยดเคลื่อนที่เข้าหาขั้วไฟฟ้าล็อคและปลดลอยนิ่งอยู่ระหว่างสนามไฟฟ้าขนาดของหยดน้ำมันที่ลอยนิ่งอยู่ระหว่างสนามไฟฟ้าสามารถสังเกตได้จากกล้องจุลทรรศน์และนำมาคำนวณหามวลของหยดน้ำมันที่สร้างความหนาแน่นของน้ำมันและจากความสำคัญของน้ำหนักของหยดน้ำมันที่ลอยนิ่งเท่ากับแรงที่เกิดจากสนามไฟฟ้าทำให้สามารถคำนวณค่าประจุไฟฟ้าบนหยดน้ำมันได้ ซึ่งพบว่าค่าประจุไฟฟ้าบนหยดน้ำมันมีค่าเป็นจำนวนเท่ากับ 1.60 × 10^-19 คูลอมบ์ มิลลิแกนจึงสรุปว่าประจุของอิเล็กตรอนมีค่าเท่ากับ 1.60 × 10^-19 คูลอมบ์ ไม่นำมาใช้คำนวณร่วมกับค่าประจุต่อมวลที่รายงานไว้โดยทอมสันจะได้หมดอิเล็กตรอนเท่ากับ 9.11 × 10^-28 กรัม
ในปีพศ. 2429 ออยเกนโกลด์ ชไตน์ ได้ทำการดัดแปลงหลอดรังสีแคโทดโดยการสลับตำแหน่งของแคโทดแอโนดซึ่งเมื่อผ่านกระแสไฟฟ้าเข้าไปพบว่าจะเกิดการเรืองแสงแสดงว่ามีรังสีจากแอโนดซึ่ง เรียกรังสีนี้ว่ารังสีแคแนลหรือรังสีแอโนดซึ่งมีประจุบวก
ในปีพ.ศ 2451 โรเบิร์ตแอนดรูส์มิลลิแกน นักวิทยาศาสตร์ชาวอเมริกันได้ทำการหาค่าประจุของอิเล็กตรอนโดยการอาศัยสังเกตหยดน้ำมันในสนามไฟฟ้า ดังรูป
ในปีพศ. 2429 ออยเกนโกลด์ ชไตน์ ได้ทำการดัดแปลงหลอดรังสีแคโทดโดยการสลับตำแหน่งของแคโทดแอโนดซึ่งเมื่อผ่านกระแสไฟฟ้าเข้าไปพบว่าจะเกิดการเรืองแสงแสดงว่ามีรังสีจากแอโนดซึ่ง เรียกรังสีนี้ว่ารังสีแคแนลหรือรังสีแอโนดซึ่งมีประจุบวก
ออยเกนโกลด์ชไตน์ได้ทำการทดลองกับแก๊สหลายชนิดพบว่ารังสีเอกซ์มีค่าประจุต่อมวลไม่คงที่จนกระทั่งกลุ่มนักวิจัยนำทีมโดยรัฐศาสตร์และทอมสันได้ทำการศึกษาหล่อในลักษณะเดียวกันที่บรรจุแก๊สไฮโดรเจนทำให้ได้ข้อสรุปว่าอนุภาคบวกมีค่าประจุเท่ากับอิเล็กตรอนและหาค่ามวลของประจุได้เป็น 1.673 × 10^-24 กรัมซึ่งมากกว่ามวลอิเล็กตรอนประมาณ 1840 เท่าที่อนุภาคนี้ว่าโปรตอน
ในปีพศ 2475 เจมส์แชดวิก นักวิทยาศาสตร์ชาวอังกฤษได้ทดลองยิงอนุภาคแอลฟาเพลงอะตอมของธาตุต่างๆและทดสอบผลการทดลองด้วยเครื่องมือที่มีความเสี่ยงสูงทำให้ทราบว่าในนิวเคลียสมีอนุภาคที่เป็นกลางทางไฟฟ้าและเรียกว่านิวตรอนซึ่งมีมวลใกล้เคียงกับมวลของโปรตอนการค้นพบนิวตรอนช่วยอธิบายและสนับสนุนข้อมูลเกี่ยวกับมวลของอะตอมซึ่งคำว่ามีค่ามากกว่ามวลรวมของโปรตอนเสื้อผ้าคาร์บอนมีมวลของโปรตอนรวมกัน 6 หน่วยประมวลของอะตอมมีค่า 12 หน่วยและมวลของธาตุส่วนใหญ่มีค่าเป็น 2 เท่าหรือมากกว่า 2 เท่าของมวลโปรตอนทั้งหมดรวมกันดังนั้นอิเล็กตรอนโปรตอนและนิวตรอนจึงเป็นอนุภาคในอะตอมซึ่งอนุภาคแต่ละชนิดมีรายละเอียด ดังนี้
2.2.2 เลขอะตอมเลขมวลและไอโซโทป
อะตอมประกอบด้วยโปรตอนและนิวตรอนรวมกันเป็นนิวเคลียสของอะตอมและมีอิเล็กตรอนซึ่งมีจำนวนเท่ากับจำนวนโปรตอนเคลื่อนที่อยู่รอบๆอะตอมของธาตุแต่ละชนิดมีจำนวนโปรตอนเฉพาะตัวไม่ซ้ำกับธาตุอื่นตัวเลขที่แสดงจํานวนโปรตอน เรียกว่า เลขอะตอม และเนื่องจากมวลของอิเล็กตรอนมีค่าน้อยมากดังนั้นเมื่อของอะตอมส่วนใหญ่จึงเป็นมวลของนิวเคลียสซึ่งประกอบด้วยโปรตอนและนิวตรอน ผลรวมของจำนวนโปรตอนและนิวตรอน ว่า เลขมวล สัญลักษณ์ที่แสดงรายละเอียดเกี่ยวกับสัญลักษณ์ของธาตุเลขอะตอมและเลขมวลของอะตอมเรียกว่าสัญลักษณ์นิวเคลียส
อะตอมของธาตุชนิดเดียวกันมีจำนวนโปรตอนและอิเล็กตรอนเท่ากันแต่จำนวนนิวตรอนอาจมีได้หลายค่าทำให้อะตอมของธาตุเดียวกันมีมวลต่างกัน เฟรเดอริก ซอดดี นักเคมีชาวอังกฤษอะตอมของธาตุเดียวกันที่มีเลขมวลต่างกันว่าไอโซโทป นอกจากนี้ยังมี ไอโซโทน ซึ่งหมายถึง ธาตุต่างชนิดกันแต่มีนิวตรอนเท่ากัน ไอโซบาร์ หมายถึง ธาตุต่างชนิดกันเลขมวลเท่ากันแต่ละอะตอมต่างกัน และไอโซอิเล็กทรอนิกส์ หมายถึง ธาตุหรือไอออนที่มีจำนวนอิเล็กตรอนเท่ากัน
2.3 การจัดเรียงอิเล็กตรอนในอะตอม
2.3.1 จำนวนอิเล็กตรอนในแต่ละระดับพลังงาน
จากการศึกษาแบบจำลองอะตอมทำให้ทราบว่าอะตอมประกอบด้วยโปรตอนและนิวตรอนอยู่รวมกันในนิวเคลียสโดยอิเล็กตรอนเคลื่อนที่อยู่รอบรอบและอยู่ในระดับพลังงานต่างกันเล็กตอนเหล่านั้นอยู่กันอย่างไรและในแต่ละระดับพลังงานจะมีอิเล็กตรอนสูงสุดเท่าไหร่ให้พิจารณาข้อมูลแสดงการจัดเรียงอิเล็กตรอนของธาตุบางธาตุดังตาราง
เมื่อพิจารณาข้อมูลแล้วจะพบว่าจำนวนอิเล็กตรอนในระดับพลังงานที่ 1 มีได้มากที่สุดคือ 2 อิเล็กตรอนระดับพลังงานที่ 2 มีได้มากที่สุดคือแบบอิเล็กตรอนสำหรับระดับพลังงานที่ 3 จากการสืบค้นข้อมูลเพิ่มเติมทำให้ทราบว่ามีมากที่สุด 18 อิเล็กตรอนด้วยคือจำนวนอิเล็กตรอนมากที่สุดที่มีได้ในแต่ระดับพลังงานจะมีค่าเท่ากับ 2n^2 เมื่อ n คือตัวเลขแสดงระดับพลังงานถ้าพิจารณาตามหลัก 2n^2 การจัดเรียงอิเล็กตรอนของธาตุ K และ Ca ควรเป็น 289 และจากการศึกษาพบว่าการจัดเรียงอิเล็กตรอนของธาตุ K และ Ca เป็น 2 8 8 1 และ 2 8 8 2 ตามลำดับซึ่งหมายความว่าอิเล็กตรอนในระดับพลังงานที่ 3 ของธาตุทั้งสองมีเพียง 8 อิเล็กตรอนและอิเล็กตรอนที่เพิ่มมา 1 และ 2 อิเล็กตรอนนั้นเข้าไปอยู่ในระดับพลังงานที่ 4 ทำให้ระดับพลังงานที่ 3 มีอิเล็กตรอนไม่ครบ 18 อิเล็กตรอน
2.3.2 ระดับพลังงานหลักและระดับพลังงานย่อย
นักเรียนทราบมาแล้วว่าโบเสนอแบบจำลองโดยใช้ข้อมูลเกี่ยวกับเส้นสเปกตรัมของไฮโดรเจนซึ่งแสดงให้เห็นว่าอะตอมของไฮโดรเจนมีพลังงานหลายระดับและความแตกต่างระหว่างพลังงานของแต่ละระดับที่อยู่ถัดไปก็ไม่เท่ากันโดยความแตกต่างของพลังงานจะมีค่าน้อยลงเมื่อระดับพลังงานสูงขึ้นการอธิบายเกี่ยวกับเส้นสเปกตรัมของโบว์ได้จุดประกายให้นักวิทยาศาสตร์หลายคนเกิดความสนใจและศึกษาเกี่ยวกับเส้นสเปกตรัมมากขึ้น และพบว่าเส้นสเปกตรัมของไฮโดรเจนที่เปล่งแสงออกมาและมองเห็นเป็นหนึ่งเส้นแท้จริงนั้นประกอบด้วยเส้นสเปกตรัมมากกว่า 1 เส้นซึ่งนำไปสู่ข้อสรุปที่ว่าเส้นสเปกตรัมที่เกิดขึ้นนอกจากเป็นการคายพลังงานของอิเล็กตรอนจากระดับพลังงานหลักซึ่งแทนด้วย n แล้วยังเป็นการ พลังงานของอิเล็กตรอนจากระดับพลังงานย่อยของแต่ละระดับพลังงานหลักอีกด้วยนักวิทยาศาสตร์ได้กำหนดระดับพลังงานย่อยเป็นตัวอักษร s p d และ f ตามลำดับ
ระดับพลังงานที่ 1 (n = ) มี 1 ระดับพลังงานย่อยคือ s ระดับพลังงานหลักที่ 2 (n = 2) มี 2 ระดับพลังงานย่อยคือ s p ระดับพลังงานที่ 3 (n = 3) มี 3 ระดับพลังงานย่อยคือ s p d และระดับพลังงานหลักที่ 4 (n = 4) มี 4 ระดับพลังงานย่อยคือ s p d f
2.3.3 ออร์บิทัล
อิเล็กตรอนมีการเคลื่อนที่ตลอดเวลาความหนาแน่นของกลุ่มหมอกอิเล็กตรอน ซึ่งอยู่ในรูปของโอกาสที่จะพบอิเล็กตรอนซึ่งมีอาณาเขตและรูปร่างใน 3 มิติแตกต่างกันบริเวณรอบนิวเคลียสซึ่งมีโอกาสที่จะพบอิเล็กตรอนและมีพลังงานเฉพาะนี้เรียกว่าออเรนทอลการศึกษา พบว่าจำนวนออร์บิทัลในแต่ละพลังงานย่อยมีค่าแตกต่างกันซึ่งสรุปได้ดังนี้ระดับพลังงานย่อย s มี 1 ออร์บิทัล ระดับพลังงานย่อย p มี 3 ออร์บิทัล ระดับพลังงานย่อยดีมี 5 ออร์บิทัล รอบพลังงานย่อย f มี 7 ออร์บิทัล
อิเล็กตรอนที่อยู่ในระดับพลังงานสูงสุดหรือชั้นนอกสุดของอะตอมเรียกว่า เวเลนซ์อิเล็กตรอน การบรรจุอิเล็กตรอน ตามลำดับระดับพลังงานโดยอาศัยแผนภาพตามหลัก อาฟบาว ดังที่กล่าวมาแล้ว มีบางธาตุที่การบรรจุอิเล็กตรอนในระดับพลังงานย่อยไม่ได้เป็นไปตามหลักการนั้น เช่น Cr มีเลขอะตอม 24 Cu มีเลขอะตอม 29
ธาตุที่ได้รับหรือเสียอิเล็กตรอน สามารถเขียนการจัดเรียงอิเล็กตรอนได้ดังนี้ 1.กรณีที่ถ้าได้รับอิเล็กตรอน ให้บรรจุอิเล็กตรอนปกติรวมกับอิเล็กตรอนที่รับเข้ามาตามลำดับระดับพลังงานโดยอาศัยแผนภาพตามหลัก อาฟบาว 2.กรณีที่ถ้าเสียอิเล็กตรอนให้บรรจุอิเล็กตรอน ตามปกติก่อนจากนั้นจึงนำอิเล็กตรอนที่อยู่ชั้นนอกสุดออก
2.4 ตารางธาตุและสมบัติของธาตุหมู่หลัก
2.4.1 วิวัฒนาการของตารางธาตุ
เมื่อมีการค้นพบธาตุและศึกษาสมบัติของธาตุเหล่านี้แล้วเราวิทยาศาสตร์ได้หาความสัมพันธ์ระหว่างสมบัติต่างๆ ของธาตุและนำมาใช้จัดตารางธาตุเป็นกลุ่มได้หลายแบบ
ในปีพศ. 2360 โยฮันน์เดอเบอไรเนอร์ เต้นนักเคมีคนแรกที่พยายามจัดตารางธาตุเป็นกลุ่มกลุ่มกลุ่มละ 3 ช่าตอนสมบัติที่คล้ายคลึงกันเรียกว่าชุดสาม โดยพบว่าท่าทางจะมีมวลอะตอมเป็นค่าเฉลี่ยของมวลอะตอมของอีก 2 ธาตุที่เหลือ ดังรูป
ในปีพ. ศ. 2427 จอห์นนิวแลนด์ นักวิทยาศาสตร์ชาวอังกฤษได้เสนอในการจัดธาตุเป็นหมวดหมู่ว่า ถ้าเรียนต่างชาติหมดอะตอมจากน้อยไปมากพบว่าถ้าที่ 8 จะมีสมบัติเหมือนท่าที่หนึ่งเสมอ โดยไม่รวมค่าไฮโดรเจนและแก๊สมีสกุล การจัดเรียงธาตุตามแนวคิดของนิวตันใช้ได้ถึงธาตุแคลเซียมเท่านั้นกดนี้ไม่สามารถอธิบายได้เพราะว่า เหตุใดมวลอะตอมจึงเกี่ยวข้องกับสมบัติที่คล้ายคลึงกันของธาตุทำให้ไม่เป็นที่ยอมรับในเวลาต่อมา ดังรูป
ในปีพศ 2412 ยูลิอุส โลทาร์ ไมเออร์ นักวิทยาศาสตร์ชาวเยอรมันและ ดิมิทรี เมนเดเลเอฟ นักวิทยาศาสตร์ชาวรัสเซียศึกษารายละเอียด ของทอดต่างๆมากขึ้นทำให้มีข้อสังเกตว่าถ้าท่านเองตามมวลอะตอมจากน้อยไปมากจะพบว่าท่านมีสมบัติคล้ายกันเป็นช่วงช่วงการที่ธาตุต่างๆมีสมบัติคล้ายกันเป็นช่วงช่วงเช่นนี้ จึงต้องเป็นกรดเรียกว่ากฎพิริออดิก การจัดธาตุเป็นหมวดหมู่ของเมนเดเลเอฟ ไม่ได้หยุดการเรียงลำดับตามมวลอะตอมจากน้อยไปมากเพียงอย่างเดียวแต่ได้นำสมบัติที่คล้ายคลึงกันของธาตุที่ปรากฏซ้ำกันเป็นช่วงๆมาพิจารณาด้วยนอกจากนี้ยังได้เว้นช่องว่างไว้โดยคิดว่าน่าจะเป็นตำแหน่งของธาตุที่ยังไม่ได้มีการค้นพบโดยที่ตำแหน่งของธาตุในตารางธาตุมีความสัมพันธ์ กับสมบัติของธาตุเมนเดเลเอฟ จึงได้ทำนายสมบัติของธาตุ ที่ยังไม่ได้มีการค้นพบ 3 ธาตุและให้ชื่อว่า เอคา-โบรอน เอคา-อะลูมิเนียม และ เอคา-ซิลิกอน ในเวลาต่อมา ก็ได้ค้นพบธาตุสแกนเดียม แกลเลียม และเจอร์เมเนียมตามลำดับ ซึ่งสมบัติใกล้เคียงกับที่ได้ทำนายไว้
ในปีพ. ศ. 2456 เฮนรี โมสลีย์ นักวิทยาศาสตร์ชาวอังกฤษ เสนอให้จัด ธาตุเรียงตามเลขอะตอม เนื่องจากสมบัติต่างๆของธาตุมีความสัมพันธ์กับประจุบวกในนิวเคลียสหรือเลขอะตอมมากกว่ามวลอะตอม ตารางธาตุในปัจจุบันจึงได้ปรับปรุงมาจากตารางธาตุของเมนเดเลเอฟแต่เรียงธาตุตามเลขอะตอมจากน้อยไปมาก ดังรูป
2.4.2 กลุ่มของธาตุในตารางธาตุ
แบ่งธาตุในแนวตั้งเป็น 18 แถวโดยเรียกแถวในแนวตั้งว่าหมู่และแบ่งธาตุในแนวนอนเป็น 7 แถวโดยเรียกแถวในแนวนอนว่าคาบ
การที่นักวิทยาศาสตร์จัดธาตุในตารางธาตุเป็นหมู่และคาบเพื่อให้ง่ายต่อการศึกษาสมบัติของธาตุต่างๆถ้าแบ่งกลุ่มของธาตุตามสมบัติความเป็นโลหะจะแบ่งได้ 3 กลุ่มคือธาตุโลหะเป็นธาตุที่นำไฟฟ้าและความร้อนได้ดีธาตุกึ่งโลหะเป็นธาตุที่นำไฟฟ้าได้ไม่ดีที่อุณหภูมิห้องจะจะนำไฟฟ้าได้ดีเมื่ออุณหภูมิสูงขึ้นและธาตุอโลหะซึ่งเป็นธาตุที่ไม่นำไฟฟ้าเลยยกเว้นคาร์บอนและฟอสฟอรัสดำเมื่อพิจารณาตำแหน่งของธาตุพบว่าธาตุโลหะอยู่ทางซ้ายมือของตารางธาตุ ธาตุอโลหะจะอยู่บริเวณที่เป็นขั้นบันไดและธาตุอโลหะจะอยู่ขวามือของตารางธาตุยกเว้นไฮโดรเจนอยู่ทางซ้ายมือของตารางธาตุ
ถ้าแบ่งกลุ่มธาตุในตารางธาตุโดยพิจารณาการจัดเรียงอิเล็กตรอน ในออร์บิทัล s p d f ที่มีพลังงานสูงสุด และมีอิเล็กตรอนบรรจุอยู่จะแบ่งธาตุได้เป็น 4 กลุ่มใหญ่คือถ้ากลุ่ม s ได้แก่ธาตุในหมู่ที่ 1 และ 2 ธาตุกลุ่ม p ได้แก่ธาตุในหมู่ที่ 13 ถึง 18 ยกเว้นฮีเลียมธาตุกลุ่มดีได้แก่ธาตุในหมู่ที่ 3 ถึง 12 ส่วนธาตุในกลุ่ม f ได้แก่กลุ่มธาตุที่อยู่ด้านล่างของตารางธาตุที่นิยมมาจากหมู่ 3 คาบที่ 6 และ 7
ธาตุกลุ่ม s และธาตุกลุ่ม p เรียกรวมกันว่า ถ้ากลุ่ม a ซึ่งเป็นกลุ่มของธาตุเรพรีเซนเททีฟ หรืออาจเรียก กลุ่มธาตุหมู่หลัก เมื่อพิจารณาการจัดเรียงอิเล็กตรอนของธาตุกลุ่มเอพบว่าถ้าในแนวตั้งที่อยู่ในกลุ่มเอจะมีเวเลนซ์อิเล็กตรอนและจำนวนเวเลนซ์อิเล็กตรอน เท่ากัน จะตรงกับเลขหมู่ธาตุบางหมู่มีการกำหนดชื่อที่เป็นสากลเช่น 5 หมู่ IA มีชื่อเรียกว่าโลหะแอลคาไล ธาตุหมู่ IIA มีชื่อเรียกว่าโลหะแอลคาไลน์เอิร์ท ธาตุหมู่ VIIA มีชื่อเรียกว่า ธาตุแฮโลเจน และธาตุหมู่ VIIIA ยกเว้น Og เรียกว่าแก๊สมีสกุล กลุ่ม d และ f เรียกรวมกันว่าธาตุกลุ่ม B หรือกลุ่มแทรนซิชัน ซึ่งแบ่งเป็นทรานซิชันชั้นนอกและธาตุแทรนซิชันชั้นในได้แก่กลุ่ม d และ f ตามลำดับ ยังสามารถแบ่งได้เป็น 2 กลุ่มย่อยกลุ่มได้อยู่คาบที่ 6 และมีเลขอะตอมตั้งแต่ 57 ถึง 71 เมื่อกลุ่มนี้ว่าแลนทานอยด์ กลุ่มที่ 2 อยู่คาบที่ 7 และมีเลขอะตอมตั้งแต่ 89 ถึง 130 กลุ่มนี้ว่ากลุ่มธาตุแอกทินอยด์ เมื่อพิจารณา การจัดเรียงอิเล็กตรอนของธาตุแทรนซิชันพบว่าจำนวนเวเลนซ์อิเล็กตรอนส่วนใหญ่เท่ากับ 2 เมื่อพิจารณาธาตุกลุ่มนี้ตามแนวนอนพบว่าจำนวนระดับพลังงานจะตรงกับเลขที่คาบเช่นเดียวกับธาตุในกลุ่มธาตุหมู่หลัก จากการศึกษาการจัดเรียงธาตุในตารางธาตุช่วยให้ทราบถึงตารางธาตุในปัจจุบันจัดธาตุเป็นหมู่และคาบโดยอาศัยสมบัติบางประการที่คล้ายกันสมบัติของธาตุหมู่หลักตามหมู่และตามคาบซึ่งได้แก่ขนาดอะตอม รัศมีไอออน พลังงานไอออไนเซชัน อิเล็กโทรเนกาติวิตี สัมพันธภาพอิเล็กตรอน
2.4.3 ขนาดอะตอม
ตามแบบจำลองอะตอมแบบกลุ่มหมอกอิเล็กตรอนที่อยู่รอบนิวเคลียสจะเคลื่อนที่ตลอดเวลาด้วยความเร็วสูงและไม่สามารถบอกตำแหน่งที่แน่นอนรวมทั้งไม่สามารถกำหนดขอบเขตที่แน่นอนของอิเล็กตรอนได้นอกจากนี้อะตอมโดยทั่วไปไม่อยู่เป็นอะตอมเดียวแต่จะมีแรงยึดเหนี่ยวระหว่างอะตอมไว้ด้วยกันถึงเป็นเรื่องยากที่จะวัดขนาดอะตอมที่อยู่ในสภาวะอิสระหรือเป็นอะตอมเดี่ยวในทางปฏิบัติจึงบอกขนาดอะตอมด้วยรัศมีอะตอมซึ่งกำหนดให้มีค่าเท่ากับครึ่งหนึ่งของระยะทางระหว่างนิวเคลียสของอะตอมทั้ง 2 ที่มีแรงยึดเหนี่ยวระหว่างอะตอมไว้ด้วยกันหรือที่อยู่ชิดกัน เพื่อศึกษา รัศมีอะตอมของธาตุทำให้ทราบขนาดอะตอมของธาตุและสามารถเปรียบเทียบขนาดอะตอมของธาตุที่อยู่ในคาบเดียวกันหรือหมู่เดียวกันได้ ดังรูป
เมื่อพิจารณาขนาดอะตอมของธาตุที่อยู่ในคาบเดียวกันพบว่า ขนาดอะตอมมีแนวโน้มลดลงหมายเลขอะตอมเพิ่มขึ้นอธิบายได้ว่าเนื่องจากธาตุในคาบเดียวกันมีเวเลนซ์อิเล็กตรอนอยู่ในระดับพลังงานเดียวกันแต่มีจำนวนโปรตอนในนิวเคลียสต่างกันเท่าที่มีจำนวนโปรตอนมากจะดึงดูดเวเลนซ์อิเล็กตรอนด้วยอะไรที่มากกว่าธาตุที่มีจำนวนโปรตอนน้อยเวเลนซ์อิเล็กตรอนจึงเข้าใกล้นิวเคลียสได้มากกว่าทำให้อิเล็กตรอนมีขนาดเล็กลงส่วนธาตุในหมู่เดียวกันเมื่อใดอะตอมเพิ่มขึ้นจำนวนโปรตอนในนิวเคลียสและจำนวนระดับพลังงานที่มีต่ออีก 1 ตอนเพิ่มขึ้นด้วยอิเล็กตรอนที่อยู่ในชั้นในจึงเป็นคล้ายฉากกั้นแรงดึงดูดระหว่างโปรตอนในนิวเคลียสกับเวเลนซ์อิเล็กตรอนทำให้แรงดึงดูดต่อ เวเลนซ์อิเล็กตรอน มีน้อยเป็นผลให้ธาตุในหมู่เดียวกันมีขนาดอะตอมใหญ่ขึ้นตามเลขอะตอม
2.4.4 ขนาดไอออน
อะตอมซึ่งมีจำนวนโปรตอนเท่ากับอิเล็กตรอนเมื่อรับอิเล็กตรอนเพิ่มเข้ามาหรือเสียอิเล็กตรอนออกไปอะตอมจะกลายเป็นไอออนการบอกขนาดของไอออนทำได้เช่นเดียวกับการบอกขนาดของอะตอม กล่าวคือ จะบอกเป็นค่ารัศมีไอออนซึ่งพิจารณาจากระยะทางระหว่างนิวเคลียสของไอออนคู่หนึ่งหนึ่งที่ยึดเหนี่ยวซึ่งกันและกันในโครงผลึก
เมื่อโลหะ ทำปฏิกิริยากับอโลหะอะตอมของโลหะจะเสียเวลาแต่เล็กจนกลายเป็นไอออนบวกจำนวนอิเล็กตรอนในอะตอมจึงลดลงทำให้แรงผลักระหว่างอิเล็กตรอนลดลงด้วยหรือกล่าวอีกนัยหนึ่งก็คือแรงดึงดูดระหว่าง ประจุในนิวเคลียสกับอิเล็กตรอนจากเพิ่มมากขึ้น Iron ห่วงจึงมีขนาดเล็กกว่าอะตอมเดิม ส่วนอะตอมของอโลหะนั้นส่วนใหญ่จะรับอิเล็กตรอนเพิ่มเข้ามาและเกิดเป็นไอออนลบเนื่องจากมีการเพิ่มขึ้นของจำนวนอิเล็กตรอนขอบเขตของกลุ่มหมอกอิเล็กตรอนจะขยายออกไปจากเดิมไอออนลบจึงมีขนาดใหญ่กว่าอะตอมเดิม ดังรูป
2.4.5 พลังงานไอออไนเซชัน
พลังงานปริมาณน้อยที่สุดที่ทำให้อิเล็กตรอนหลุดจากอะตอมในสถานะแก๊สเรียกว่าพลังงานไอออไนเซชัน โดยค่า IE แสดงถึงความยากง่ายในการทำให้ อะตอมในสถานะแก๊สกลายเป็นไอออนบวก โดยอีน้อยแสดงว่าทำให้เป็นไอออนบวกได้ง่ายแต่ถ้า IE มากแสดงว่าทำให้เป็นไอออนบวกได้ยากก็ทำให้ไฮโดรเจนอะตอมในสถานะแก๊สกลายเป็นไรโดยเช่นไอออนและสถานะแก๊สเขียนได้ ดังนี้
H(g) ==> H^+(g) + e^-
การทำให้อิเล็กตรอนหลุดออกจากอะตอมของไฮโดรเจนจะต้องใช้พลังงานอย่างน้อยที่สุด 1318 กิโลจูลต่อโมล นั่นคือ พลังงานไอออไนเซชันของไฮโดรเจนอะตอมเท่ากับ 1318 กิโลจูลต่อโมล ธาตุไฮโดรเจน มี 1 อิเล็กตรอนจึงมีค่าพลังงานไอออไนเซชันเพียงค่าเดียวถ้าธาตุที่มีหลายอิเล็กตรอน ก็จะมีพลังงานไอออไนเซชันหลายค่าพลังงานที่น้อยที่สุดที่ทำให้อิเล็กตรอนตัวแรกหลุดออกมาจากอะตอม ที่อยู่ในสถานะแก๊สเรียกว่าพลังงานไอออไนเซชันลำดับที่ 1 เขียนย่อเป็น IE 1 พลังงานที่ทำให้อิเล็กตรอนในลำดับต่อๆมาหลุดออกมาจากอะตอมเรียกว่าพลังงานไอออไนเซชันลำดับที่ 2 3 ... และเขียนย่อเป็น IE 2 IE 3 ตามลำดับ
2.4.6 สัมพรรคภาพอิเล็กตรอน
พลังงานที่ถูกคายออกมาเมื่ออะตอมในสถานะแก๊สได้รับอิเล็กตรอน 1 อิเล็กตรอนเลขว่าสัมพรรคภาพอิเล็กตรอนเขียนสมการการเปลี่ยนแปลงได้ ดังนี้
A(g) + e^==> A^-(g)
หาค่าสัมพรรคภาพอิเล็กตรอน มีค่าเป็นบวกหมายความว่าอะตอมคายพลังงานเมื่อได้รับอิเล็กตรอนแสดงว่าอะตอมของธาตุนั้นมีแนวโน้มที่จะได้รับอิเล็กตรอนได้ดี ถ้าค่าสัมพรรคภาพอิเล็กตรอนเป็นลบแปลว่าต้องใช้พลังงานเพิ่มเข้าไปเพื่อให้และรับอิเล็กตรอนได้เพิ่มขึ้น 1 อิเล็กตรอน เมื่อพิจารณาตามข้อพบว่าค่าสัมพรรคภาพอิเล็กตรอนของธาตุอโลหะยกเว้น หมู่ VIIIA มีค่ามากกว่าธาตุโลหะแสดงว่าธาตุอโลหะมีแนวโน้มที่จะได้รับอิเล็กตรอนได้ดีกว่าถ้าโลหะเมื่อพิจารณาโดยภาพรวมทั้งหมดจะพบว่าธาตุหมู่ VIIA มีค่าสัมพรรคภาพอิเล็กตรอนสูงที่สุดแสดงว่ามีแนวโน้มในการรับอิเล็กตรอนได้ดีกว่าท่านผู้อื่นที่เป็นเช่นนี้อาจอธิบายได้ว่าการรับ 1 อิเล็กตรอนของธาตุในหมู่นี้จะทำให้มีอะตอมที่มีการจัดเรียงอิเล็กตรอนของธาตุหมู่ VIIA หรือแก๊สมีสกุลซึ่งมีความเสถียรมาก
2.4.7 อิเล็กโทรเนกาติวิตี
อิเล็กโทรเนกาติวิตีความสามารถของอะตอมในการดึงดูดอีเล็คตรอนคู่ที่ใช้ร่วมกันในโมเลกุลของสารแนวโน้มค่าอิเล็กโทรเนกาติวิตีของธาตุในตารางเป็นดังนี้
เมื่อพิจารณาค่าอิเล็กโทรเนกาติวิตีของธาตุในคาบเดียวกันพบว่ามีแนวโน้มเพิ่มขึ้นตามเลขอะตอมเนื่องจากในคาบเดียวกันอะตอมของธาตุหมู่ IA มีขนาดใหญ่ที่สุดและหมู่ VIIA มีขนาดเล็กที่สุด ความสามารถในการดึงดูดอีเล็คตรอนตามข้ามจึงเพิ่มขึ้นจากหมู่ IA ไปหมู่ VIIA ดังนั้นในคาบเดียวกันธาตุหมู่ IA จึงมีค่าอิเล็กโทรเนกาติวิตีต่ำที่สุดควรธาตุหมู่ VIIA มีค่าอิเล็กโทรเนกาติวิตีสูงที่สุดธาตุในหมู่เดียวกันมีแนวโน้มของค่าอิเล็กโทรเนกาติวิตี ลดลงเมื่อเลขอะตอมเพิ่มขึ้นเนื่องจากขนาดของอะตอมที่เพิ่มขึ้นเป็นผลให้นิวเคลียสดึงดูดอิเล็กตรอนลดลง
2.5 ธาตุแทรนซิชัน
สมบัติของธาตุหมู่ A มาแล้วต่อไปจะได้ศึกษาธาตุอีกกลุ่มหนึ่งซึ่งอยู่ระหว่างธาตุหมู่ IA และหมู่ IIIA ที่เรียกว่าถ้าแทรนซิชันประกอบด้วยธาตุหมู่ IB ถึงหมู่ VIIIB รวมทั้งกลุ่มธาตุแลนทานอยด์และแอกทินอยด์ 2.6 ธาตุกัมมันตรังสี
ถ้ามีกลุ่มหนึ่งในตารางธาตุซึ่งมีสมบัติแตกต่างจากที่เคยศึกษามาแล้วคือสามารถแผ่รังสีแล้วกลายเป็นอะตอมของธาตุใหม่ได้ ในปีพศ. 2439 อองตวนอองรีแบ็กเกอแรล นักวิทยาศาสตร์ชาวฝรั่งเศสพบว่าเมื่อเก็บแผ่นฟิล์มถ่ายรูปที่หุ้มด้วยกระดาษสีดำไว้กับสารประกอบของยูเรเนียม แผ่นฟิล์มจะมีลักษณะเหมือนถูกแสงและเมื่อทำการทดลองกับสารประกอบของยูเรเนียมชนิดอื่นๆก็ได้ผลเช่นเดียวกันจึงสรุปว่าน่าจะมีรังสีแพรออกมาจากธาตุยูเรเนียมต่อมาปีแอร์ กูรี และมารีกูรี ได้ค้นพบว่า ธาตุพอโลเนียมเรเดียมและทอเรียม ก็สามารถ รังสีได้เช่นเดียวกันปรากฏการณ์ที่ธาตุแพ้รังสีเองได้อย่างต่อเนื่องเรียกว่ากัมมันตภาพรังสี ซึ่งเป็นการเปลี่ยนแปลงภายในนิวเคลียส ของไอโซโทปที่ไม่เสถียรและไอโซโทปของธาตุที่สามารถแผ่รังสีเองได้อย่างต่อเนื่องเรียกว่าไอโซโทปกัมมันตรังสีหรือสารกัมมันตรังสี
2.6.1 การเกิดกัมมันตภาพรังสี
การเกิดกัมมันตภาพรังสีเป็นปรากฏการณ์ที่เกิดกับไอโซโทปกัมมันตรังสีเพราะนิวเคลียสมีพลังงานสูงมากและไม่เสถียรจึงปล่อยพลังงานออกมาในรูปของอนุภาคหรือรังสีจากการศึกษานักวิทยาศาสตร์แสดงให้เห็นว่ารังสีที่แผ่ออกมาจากไอโซโทปกัมมันตรังสีอาจเป็นรังสีแอลฟาบีตาหรือแกมมาสมบัติของรังสีบางชนิด
2.6.2 การสลายตัวของไอโซโทปกัมมันตรังสี
จากการศึกษาไอโซโทป ของธาตุจำนวนมากทำให้ได้ข้อสังเกตว่า ไอโซโทปของนิวเคลียสที่มีอัตราส่วนระหว่างจำนวนนิวตรอนต่อจำนวนโปรตอนไม่เหมาะสมคือนิวเคลียสที่มีจำนวนนิวตรอนแตกต่างจากจำนวนโปรตอนมากเกินไปและจะไม่เสถียรจึงเกิดการเปลี่ยนแปลงภายในนิวเคลียสโดยการแผ่รังสีออกมาแล้วเกิดเป็นนิวเคลียสของธาตุใหม่ที่เสถียรกว่า
การแผ่รังสีบีตา เกิดกับนิวเคลียสที่มีจำนวนนิวตรอนมากกว่าโปรตอนมาก นิวตรอนในนิวเคลียสจะเปลี่ยนไปเป็นโปรตอนและอิเล็กตรอนซึ่งอิเล็กตรอนจะถูกปลดปล่อยออกจากนิวเคลียสในรูปของรังสีบีตาและนิวเคลียสใหม่จะมีเลขอะตอมเพิ่มขึ้น 1 โดยมวลยังคงเดิม
การแผ่รังสีแกมมา เกี่ยวกับไอโซโทปกัมมันตรังสีที่มีพลังงานสูงมากหรือไอโซโทปที่สลายตัวให้รังสีแอลฟาหรือบีตา แต่นิวเคลียสที่เกิดใหม่ยังไม่เสถียรเพราะมีพลังงานสูงจึงเกิดการเปลี่ยนแปลงให้มีพลังงานต่ำลงโดยปล่อยพลังงานส่วนเกินออกมาเป็นรังสีแกมมา
การแผ่รังสีแอลฟา ส่วนใหญ่เกิดจากนิวเคลียสที่มีเลขอะตอมสูงกว่า 83 และมีจำนวนนิวตรอนต่อโปรตอนในสัดส่วนที่ไม่เหมาะสม เมื่อปล่อยรังสีแอลฟาออกมา จะกลายเป็นนิวเคลียสของธาตุใหม่ที่เสถียรซึ่งมีเลขอะตอมลดลง 2 และเลขมวลลดลง
2.6.3 อันตรายจากไอโซโทปกัมมันตรังสี
กิจวัตรต่างๆในชีวิตประจำวันทั้งการรับประทานอาหารดื่มน้ำหายใจด้วยมีโอกาสที่มนุษย์จะได้รับรังสีจากไอโซโทปกัมมันตรังสีเข้าสู่ร่างกายนอกจากนี้ยังได้รับรังสีคอสมิกซึ่งเป็นรังสีที่ส่วนใหญ่มาจากอวกาศและสิ่งต่างๆเหล่านี้มีแหล่งกำเนิดจากธรรมชาตินอกจากนี้บางคนยังได้รับรังสีที่มนุษย์สร้างขึ้นมาเช่นรังสีจากโรงไฟฟ้านิวเคลียร์ แม้มนุษย์จะได้รับรังสีจากกิจวัตรประจำวันแต่การได้รับรังสีจากธรรมชาติหรือจากที่มนุษย์สร้างขึ้นในปริมาณเพียงเล็กน้อยโดยน้อยกว่า 100 มิลลิซีเวิร์ต เซลล์เนื้อเยื่อ สามารถฟื้นตัวได้แต่การได้รับรังสีมากกว่า 100 มิลลิซีเวิร์ต ทำให้เกิดความเสี่ยงต่อสุขภาพได้ เช่นการคลื่นไส้ การอาเจียนอา การปวดหัว การเป็นมะเร็ง สำหรับหน่วยงานที่ทำงานเกี่ยวกับรังสีจะต้องแสดงสัญลักษณ์รังสีลงบนฉลาก ของพันชนะหรือเครื่องมือ รวมทั้งบริเวณใกล้เคียงเพื่อให้ผู้พบเห็นได้ระมัดระวัง สัญลักษณ์รังสีใช้เป็นมาตรฐานจะได้รูปใบพัด 3 แฉกมีสีม่วงอ่อนม่วงเข้มหรือสีดำบนพื้นสีเหลือง ดังรูป
เนื่องจากสัญลักษณ์รังสีดังรูปสื่อความหมายไม่ได้ชัดเจนหรือบุคคลที่ไม่เกี่ยวข้องอ่านไม่เข้าใจความหมายดังนั้น ทบวงปรมาณูระหว่างประเทศ และองค์กรระหว่างประเทศว่าด้วยมาตรฐานได้ออกแบบสัญลักษณ์ใหม่เป็นรูปคลื่นของรังสีกะโหลกไขว้และคนกำลังวิ่ง ดังรูป
2.6.4 ครึ่งชีวิตของไอโซโทปกัมมันตรังสีไอโซโทป
กัมมันตรังสีจะสลายตัวให้รังสีชนิดใดชนิดหนึ่งออกมาได้เองตลอดเวลาไอโซโทปกัมมันตรังสีแต่ละชนิดจะสลายตัวได้เร็วหรือช้าแตกต่างกันอัตราการสลายตัวของไอโซโทปกัมมันตรังสีจะบอกเป็นครึ่งชีวิตใช้สัญลักษณ์ t1/2 โดยหมายถึงระยะเวลาที่นิวเคลียสของไอโซโทปกัมมันตรังสีสลายตัว จนเหลือครึ่งหนึ่งของปริมาณเดิมไอโซโทปกัมมันตรังสีของธาตุชนิดหนึ่งหนึ่งจะมีครึ่งชีวิตคงเดิมไม่ว่าจะอยู่ในรูปของธาตุหรือเกิดเป็นสารประกอบ ตัวอย่าง ดังรูป
โดยสูตรการคำนวณครึ่งชีวิต มีดังนี้
Nเหลือ = Nเริ่มต้น/2n
T = nt1/2
โดย Nเหลือ แทนปริมาณกัมตรังสีที่เหลือ
T แทนจำนวนเวลาที่ธาตุสลายตัว
Nเริ่มต้น แทนปริมาณกับมมันตรังสีเริ่มต้น
n แทนจำนวนครั้งในการสลายตัวของครึ่งชีวิต
2.6.5 ปฏิกิริยานิวเคลียร์
ปฏิกิริยานิวเคลียร์เป็นการเปลี่ยนแปลงในนิวเคลียสของไอโซโทปกัมมันตรังสีเกิดจากการแตกตัวของนิวเคลียสของอะตอมที่มีขนาดใหญ่หรือเกิดจากการรวมตัวของนิวเคลียสของอะตอมที่มีขนาดเล็กแล้วได้ไอโซโทปใหม่หรือนิวเคลียสของธาตุใหม่รวมทั้งมีพลังงานเกี่ยวข้องกับปฏิกิริยาเป็นจำนวนมหาศาลซึ่งสามารถนำมาใช้ประโยชน์ได้
ในปีพศ. 2482 นักวิทยาศาสตร์ได้ค้นพบว่าเมื่อยิงอนุภาคนิวตรอนไปยังนิวเคลียส U-235 นิวเคลียสจะแตกออกเป็นนิวเคลียสของธาตุที่เบากว่า กระบวนการที่นิวเคลียสของไอโซโทปของธาตุบางชนิดแตกออกเป็นไอโซโทปของธาตุที่เบากว่าดังตัวอย่างที่กล่าวมาแล้วเรียกว่า ฟิชชัน ไอโซโทปของธาตุอื่นที่สามารถเกิดฟิชชันได้ เช่น U-238 การเกิดฟิชชัน แต่ละครั้งจะคายพลังงานออกมาเป็นจำนวนมากและได้ไอโซโทปกัมมันตรังสีหลายชนิดซึ่งถือว่าได้เป็นวิธีผลิตไอโซโทปกัมมันตรังสีที่สำคัญนอกจากนี้ฟิสชั่นยังได้นิวตรอนเกิดขึ้นอีกด้วย ถ้านิวตรอนที่เกิดขึ้นใหม่นี้ชนกับนิวเคลียสอื่นจะเกิดเป็นฟิชชันต่อเนื่องไปเรื่อยๆเรียกปฏิกิริยานี้ว่า ปฏิกิริยาลูกโซ่
ฟิชชันที่เกิดภายในภาวะที่เหมาะสม จะได้จำนวนนิวตรอนเพิ่มขึ้นอย่างรวดเร็วทำให้ฟิชชัน
ดำเนินไปอย่างรวดเร็วและปล่อยพลังงานออกมาเป็นจำนวนมหาศาลถ้าไม่สามารถควบคุมปฏิกิริยาได้อาจเกิดการระเบิดรุนแรงหลักการเกิดปฏิกิริยาลูกโซ่ได้นำมาใช้ในการทำระเบิดปรมาณูการควบคุมฟิชชันทำได้หลายวิธี เช่นควบคุมมวลของสารตั้งต้นให้น้อยลงเพื่อให้จำนวนนิวตรอนที่เกิดมีไม่เพียงพอที่จะทำให้เกิดปฏิกิริยาลูกโซ่ได้ ในกรณีที่นิวเคลียสของธาตุเบา 2 ชนิดหลอมรวมกันเกิดเป็นนิวเคลียสใหม่ที่มีมวลสูงกว่า เดิมและให้พลังงานปริมาณมาก ปฏิกิริยานี้เรียกว่า ฟิวชัน ปฏิกิริยาทั้งสองนี้เป็นปฏิกิริยากับที่เกิดบนดวงอาทิตย์การเกิดฟิวชันจะต้องใช้พลังงานเริ่มต้นสูงมากและเอาชนะแรงผลักระหว่างนิวเคลียสที่จะเข้าร่วมกันซึ่งประมาณว่าจะต้องมีอุณหภูมิสูงถึงหลายล้านองศาเซลเซียส พลังงานมหาศาลนี้อ่านได้จากฟิชชันซึ่งเปรียบเสมือนฉนวนที่ทำให้เกิดฟิวชั้น ถ้าพลังงานที่ปล่อยออกมามาจากฟิวชันเกิดขึ้นอย่างรวดเร็วจะเกิดการระเบิดอย่างรุนแรงแต่ถ้าควบคุมให้มีการปล่อยพลังงานออกมาอย่างช้าๆและต่อเนื่องจะให้พลังงานมหาศาลที่เป็นประโยชน์ต่อมนุษย์ฟิวชันมีข้อได้เปรียบมากกว่าฟิชชันหลายประการกล่าวคือคายพลังงานออกมาม่าสารตั้งต้นของฟิวชันหาได้ง่ายและมีปริมาณมากนอกจากนี้ผลิตภัณฑ์ที่เกิดจากฟิวชันเป็นธาตุกัมมันตรังสีที่มีครึ่งชีวิตสั้นและมีอันตรายน้อยกว่า ผลิตภัณฑ์จากการเกิดฟิชชัน แม้จะมีการค้นพบกระบวนการฟิวชั่นมานานแต่ การนำมาใช้อย่างเป็นรูปธรรม เป็นไปได้ยากเพราะการเกิดฟิวชั้นต้องใช้อุณหภูมิสูงมากซึ่งที่สภาวะนี้แสนจะเปลี่ยนเป็นรูป Plasma ซึ่งไม่เสถียรดังนั้นการควบคุมกระบวนการฟิวชันให้เกิดอย่างต่อเนื่องเป็นไปได้ยากมาก 2.6.6 เทคโนโลยีที่เกี่ยวข้องกับการใช้สารกัมมันตรังสี
สารกัมมันตรังสีแต่ละชนิดมีครึ่งชีวิตไม่เท่ากันและแผ่รังสีได้แตกต่างกันการนำสารกัมมันตรังสีมาใช้ประโยชน์จึงแตกต่างกัน
ด้านธรณีวิทยา ใช้ C-14 ซึ่งมีครึ่งชีวิต 5730 ปีหาอายุของวัตถุโบราณที่มีคาร์บอนเป็นองค์ประกอบ เช่นไม้กระดูกการหาอายุโบราณโดยการวัดปริมาณของ C-14 อธิบายได้ว่าในบรรยากาศมี C-14 ซึ่งเกิดจากไนโตรเจนรวมตัวกับนิวตรอนจากรังสีคอสมิก
ด้านการแพทย์ ใช้เพื่อศึกษาความผิดปกติของอวัยวะต่างๆในร่างกายโดยให้คนไข้รับประทานอาหารหรือยาที่มีไอโซโทปกัมมันตรังสีจำนวนเล็กน้อยจากนั้นใช้เครื่องมือตรวจสอบรังสีเพื่อติดตามดูผลการดูดซึมของไอโซโทปกัมมันตรังสีของระบบอวัยวะต่างๆ
ด้านเกษตรกรรม ใช้ไอโซโทปกัมมันตรังสีในการติดตามระยะเวลาของการหมุนเวียนแร่ธาตุในพืชโดยเริ่มจากการดูดซึมที่รากจนถึงการคายออกที่ใบ หรือจำนวนแร่ธาตุที่พืชสะสมไว้ในใบ
ด้านอุตสาหกรรม ใช้ไอโซโทปกัมมันตรังสีกับงานหลายอย่างเช่นใช้ตรวจหารอยตำหนิในโลหะหรือรอยรั่วของท่อขนส่งของเหลวผสมไอโซโทปกัมมันตรังสีกับของเหลวที่จะขนส่งไปตามท่อและติดตามการแผ่รังสีด้วยเครื่องไกเกอร์ มึลเลอร์ เคาน์เตอร์ บริเวณใดที่มี สัญญาณจำนวนนับมากผิดปกติแสดงว่าบริเวณนั้นมีการรั่วไหลเกิดขึ้น
2.7 การนำธาตุไปใช้ประโยชน์และผลกระทบต่อสิ่งมีชีวิตมนุษย์
2.7.1 ประโยชน์ของธาตุ
การจำแนกธาตุออกเป็นกลุ่มนอกจากจะช่วยให้ง่ายต่อการศึกษาสมบัติของธาตุแล้วยังง่ายต่อการพิจารณาสมบัติที่เหมาะสมในการนำไปประยุกต์ใช้งานอีกด้วย
-ธาตุโลหะ มีสมบัติการนำความร้อนและไฟฟ้าได้ดีจึงนิยมนำมาเป็นอุปกรณ์นำไฟฟ้าเช่นนำทองแดงมาทำสายไฟน้ำสังกะสีมาทำขั้วไฟฟ้าของถ่านไฟฉาย
-ธาตุกึ่งโลหะ เช่นซิลิกอน เจอร์เมเนียม มีสมบัติก้ำกึ่งระหว่างโลหะกับโลหะ นำไฟฟ้าได้แต่นำไม่ดีนิยมนำมาทำเป็นสารกึ่งตัวนำ
-ธาตุหมู่ 18 เป็นธาตุที่เฉยต่อการเกิดปฏิกิริยาจึงนำมาใช้ประโยชน์ตามสมบัติของแก๊สมีสกุลเช่นนำ-ฮีเลียมซึ่งมีความหนาแน่นน้อยกว่าอากาศมาบรรจุในบอลลูนและเรือเหาะแทนแก๊สไฮโดรเจน
-ธาตุมีไอโซโทปกัมมันตรังสี สามารถนำมาใช้ประโยชน์ได้ดังที่กล่าวไว้ในหัวข้อ 2.6.6 และธาตุุที่อยู่กลุ่มเดียวกันจะมีสมบัติคล้ายกันแต่ถ้าชุดชนิดยังมีสมบัติเฉพาะตัวที่แตกต่างกันด้วยดังนั้นการนำไปใช้ประโยชน์จึงมีความจำเพาะแตกต่างกันการที่ธาตุแต่ละชนิดมีสมบัติเฉพาะตัวแตกต่างกันทำให้บางครั้งนักวิทยาศาสตร์ต้องนำธาตุมากกว่า 1 ชนิดมาละลายหรือผสมกันเพื่อให้มีสมบัติตามที่ต้องการและนำไปใช้ประโยชน์ได้หลากหลายมากขึ้น
2.7.2 ผลกระทบต่อสิ่งมีชีวิตและสิ่งแวดล้อม
จากความรู้เดิมโครงสร้างมาแล้วว่าธาตุบางชนิดส่งผลกระทบต่อสิ่งมีชีวิตและสิ่งแวดล้อมเช่นตะกั่วได้ถูกใช้ในอุตสาหกรรมผลิตแบตเตอรี่ ล้วนส่งผลกระทบต่อสิ่งมีชีวิตเช่นถ้าตะกั่วปนเปื้อนในน้ำอาจจะส่งผลต่อการเจริญเติบพันธ์ระบบโลหิตและระบบประสาทของสัตว์ในแหล่งน้ำนั้นได้
สมัครสมาชิก:
ความคิดเห็น (Atom)
-
1.1 ความปลอดภัยในการทำงานกับสารเคมี 1.1.1 ประเภทของสารเคมี สารเคมีมีหลายปรเภท แต่ละประเภทมีสมบัติแตกต่างกัน สารเคมีจึงจำเป็นต...
-
2.1 แบบจำลองอะตอม 2.1.1 แบบจำลองอะตอมของดอลตัน ในปีพ.ศ 2346 จอห์นดอลตัน นักวิทยาศาสตร์ชาวอังกฤษได้เสนอทฤษฎีอ...
















































